
NOTA: Para la correcta visualización de esta página se requiere el navegador Nestcape Communicator versiones 4.5. a 4.78, con los plugins Chime 2.6 SP4 y Macromedia Flash player. Para más información: hoja de prueba de plugins.
Las propiedades del agua radican en la simplicidad de su estructura molecular formada por dos átomos de hidrógeno y uno oxígeno a través de dos enlaces O—H .
Los enlaces O—H se forman por solapamiento de un orbital sp3 oxígeno (el oxígeno presenta cuatro orbitales hibridos sp3, dispuestos según los vértices de un tetraedro)y un orbital 1s del hidrógeno. Los átomos de hidrógeno de la molécula de agua se localizan en dos vértices del tetraedro, mientras que los dos pares de electrones del oxígeno que no participan en el enlace se localizan en los otros dos vértices.
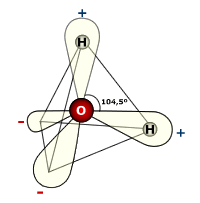 |
La carga neta de la molécula de agua es cero, no obstante una cierta polaridad debido a la diferencia de electronegatividades entre el oxígeno (3,5) y el hidrógeno (2,1). Esta diferencia de polaridad entre los átomos de oxígeno y hidrógeno conlleva a la deformación de la nube electrónica del enlace, favoreciendo que los electrones se encuentren más cerca del oxígeno que del hidrógeno, de esta forma el oxígeno tiene una cierta densidad de carga negativa y el hidrógeno una cierta densidad de carga positiva, formando un dipolo permanente.
Estos puentes de hidrógeno entre las diferentes moléculas de agua son los que permiten que el agua sea líquida en un intervalo de temperatura muy amplio (0° a 100°C). Cada molécula de agua puede unirse por puentes de hidrógeno a otras 4 moléculas en disposición tetraédrica.
|
|
Agua | Hielo | |