![]()
La vitamina B6 es la coenzima fundamental del metabolismo de los aminoácidos.
El grupo vitamínico B6 comprende:
piridoxal
|
piridoxina
|
piridoxamina
|
 |
 |
 |
![]()
La estructura funcional de la vitamina B6 es el fosfato de piridoxal. Se forma
por esterificación de la función alcohol en posición 5,
por una molécula de ácido fosfórico
.
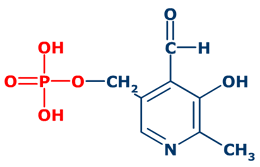 |
La presencia del grupo fosfato es esencial para la acción de la coenzima, ya que en ausencia del grupo fosfato se formaría un hemi-acetal que bloquearía la función aldehído .
 |
A pH fisiológico el fosfato de piridoxal se presenta en forma de ion dipolar :
 |
Así la presencia del nitrógeno del heterociclo es un punto que atrae a los electrones de forma particular, lo que va a condicionar todo el funcionamiento de la coenzima.
La especie reactiva del fosfato de piridoxal no es el grupo aldehído sino una aldimina, que se forma entre la coenzima y un grupo -amino de un residuo lisina en el lugar activo de la enzima.
 |
![]()
El fosfato de piridoxal pertenece al tipo de coenzimas capaces de participar
en varias reacciones metabólicas muy diferentes entre sí:
la especificidad de la reacción catalizada corresponde únicamente
a la apoenzima específica a la que está unida.
Esta molécula simple va a servir de coenzima para reacciones del metabolismo
de los aminoácidos tan diversas como:
- transaminación
- racemización
- eliminación de grupos [OH] y [SH] (eliminación en ![]() -
-![]() )
)
- descarboxilación
- reacciones de eliminación de grupos carbonados
es decir, todos los grandes procesos fundamentales del catabolismo de los aminoácidos. Así, la importancia biológica de esta coenzima es excepcional.
En el mecanismo de acción se distinguen cuatro etapas fundamentales:
1. Formación de una imina inicial: la reacción
comienza con la formación de una nueva base de Schiff (aldimina) entre
el grupo ![]() -amino
del aminoácido y el fosfato de piridoxal.
-amino
del aminoácido y el fosfato de piridoxal.
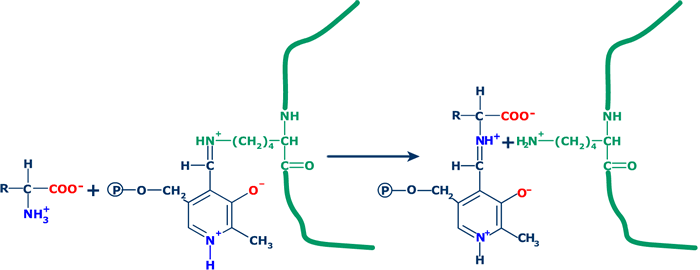 |
En esta base de Schiff tenemos que entre el carbono ![]() y el nitrógeno cuaternario del heterociclo se establece un sistema de
dobles enlaces conjugados; así los electrones que participan en los enlaces
del carbono
y el nitrógeno cuaternario del heterociclo se establece un sistema de
dobles enlaces conjugados; así los electrones que participan en los enlaces
del carbono ![]() muestran
tendencia a migrar hacia el grupo N+, es decir se encuentran debilitados.
muestran
tendencia a migrar hacia el grupo N+, es decir se encuentran debilitados.
Esta nueva base de Schiff se mantiene unida a la enzima por diversas fuerzas
intermoleculares.
Los tres enlaces (H, R, COO-) del carbono no están debilitados de igual
manera: corresponde a la apoenzima proteica específica asociada al fosfato
de piridoxal el orientar la distribución de los electrones alrededor
del carbono ![]() , de forma
que uno de los tres enlaces se debilita más que los otros dos.
, de forma
que uno de los tres enlaces se debilita más que los otros dos.
2. Eliminación de un grupo cargado positivamente
por rotura de un enlace debilitado en el carbono alfa del aminoácido:
La eliminación de un grupo cargado positivamente por rotura de un enlace
debilitado en el carbono ![]() del aminoácido: esto da lugar a una imina transicional. Hay tres posibilidades
de eliminación de grupos, según el enlace debilitado, en función
de la apoenzima específica que intervenga en la reacción. Cualquiera
que sea el grupo afectado, se elimina bajo la forma de un ion cargado positivamente,
obteniéndose una de las tres iminas transicionales según la naturaleza
del enlace roto.
del aminoácido: esto da lugar a una imina transicional. Hay tres posibilidades
de eliminación de grupos, según el enlace debilitado, en función
de la apoenzima específica que intervenga en la reacción. Cualquiera
que sea el grupo afectado, se elimina bajo la forma de un ion cargado positivamente,
obteniéndose una de las tres iminas transicionales según la naturaleza
del enlace roto.
 |
3. Deslocalización electrónica seguida de
una protonación. Tras la eliminación de los posibles grupos
(H+, CO2 o R+) se da la formación de
un carbanión, el electrón residual en exceso se estabiliza sobre
el carbono ![]() , al darse
una deslocalización electrónica. La estructura obtenida de esta
manera es estable porque la carga negativa se compensa mediante la adición
de un protón H+: ésta es la protonación que
sigue a la deslocalización electrónica.
, al darse
una deslocalización electrónica. La estructura obtenida de esta
manera es estable porque la carga negativa se compensa mediante la adición
de un protón H+: ésta es la protonación que
sigue a la deslocalización electrónica.
4. Hidrólisis y liberación de los productos de la reacción. En la última etapa se produce la hidrólisis y liberación de los diferentes productos finales de la reacción.
 |

![]()
Las transaminasas, racemasas, enzimas de eliminación en ![]() -
-![]() y enzimas de eliminación
y enzimas de eliminación ![]() se caracterizan por la formación de la imina transicional a (perdida
del protón).
se caracterizan por la formación de la imina transicional a (perdida
del protón).
 |
![]()
Las transaminasas catalizan la transferecia del grupo amino de un aminoácido a un cetoácido, por ejemplo la alanina transaminasa (transaminasa glutamico-pirúvica):
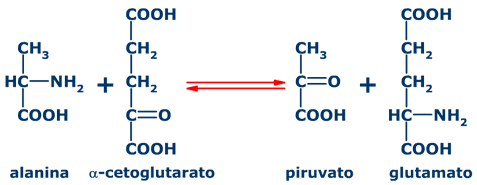 |
En las transaminasas la localización electrónica y la protonación
correspondeinte tienen lugar sobre el carbono formilo.
En consecuencia, tiene lugar una remodelación del sistema de dobles
enlaces conjugados, con reaparición de una carga positiva sobre el nitrógeno
del heterociclo. En la hidrólisis que se produce a continuación
(4 etapa) se liberan la piridoxamina fosfato y un ácido ![]() -cetónico.
-cetónico.
Al final de la reacción, la piridoxamina fosfato lleva pues el grupo
NH2 desprendido del aminoácido inicial: lo perderá
transfiriéndolo a otro ácido ![]() -cetónico,
y de esta forma se regenerará el piridoxal fosfato: éste es el
principio de la transaminación.
-cetónico,
y de esta forma se regenerará el piridoxal fosfato: éste es el
principio de la transaminación.
![]()
Las racemasas catalizan interconversiones entre isómeros ópticos,
por ejemplo la alanina racemasa.
 |
La localización electrónica y la protonación tienen lugar
en este caso sobre el carbono en ![]() .
Ello trae como consecuencia la remodelación del sistema de dobles enlaces
conjugados y la reaparición, de la carga positiva sobre el nitrógeno
del heterociclo.
.
Ello trae como consecuencia la remodelación del sistema de dobles enlaces
conjugados y la reaparición, de la carga positiva sobre el nitrógeno
del heterociclo.
La hidrólisis (4 etapa) libera el mismo aminoácido, pero de la
serie estérica opuesta
![]()
En el caso de un radical R del tipo ( -CH2).
-CH2).
 es, con frecuencia un grupo electrófilo:
por ejemplo -OH o -SH. El mecanismo es muy sencillo, por ejemplo la cisteín-desulfhidrasa.
es, con frecuencia un grupo electrófilo:
por ejemplo -OH o -SH. El mecanismo es muy sencillo, por ejemplo la cisteín-desulfhidrasa.
 |
![]()
Este tipo de mecanismo es el de la descarboxilación de los aminoácidos.
La reordenación electrónica y la protonación correspondiente
tienen lugar sobre el carbono ![]() .
Se produce una remodelación del sistema de dobles enlaces conjugados
y la reaparición de una carga positiva sobre el nitrógeno del
heterociclo. La hidrólisis que tiene lugar a continuación (etapa
4) libera una amina y regenera el fosfato de piridoxal.
.
Se produce una remodelación del sistema de dobles enlaces conjugados
y la reaparición de una carga positiva sobre el nitrógeno del
heterociclo. La hidrólisis que tiene lugar a continuación (etapa
4) libera una amina y regenera el fosfato de piridoxal.
Son ejemplos de este tipo de reacciones las transformaciones: |
|
|
|
![]()
Este mecanismo es característico de la eliminación del grupo
alcohólico (R) de un aminoácido.
La localización electrónica y la protonación correspondiente
tienen lugar sobre el carbono ![]() .
Se produce una remodelación de los dobles enlaces conjugados y la
reaparición
de una carga positiva sobre el nitrógeno del heterociclo. La hidrólisis
termina (etapa 4) liberando un aminoácido, del que se ha eliminado
el grupo R, y regenerando el fosfato de piridoxal.
.
Se produce una remodelación de los dobles enlaces conjugados y la
reaparición
de una carga positiva sobre el nitrógeno del heterociclo. La hidrólisis
termina (etapa 4) liberando un aminoácido, del que se ha eliminado
el grupo R, y regenerando el fosfato de piridoxal.