Fundamentos de las prácticas de laboratorio |
 La
radiación electromagnética está constituida por una
onda formada por dos campos uno eléctrico y otro magnético
que oscilan perpendiculares uno del otro y ambos perpendiculares a la dirección
de propagación. La
radiación electromagnética está constituida por una
onda formada por dos campos uno eléctrico y otro magnético
que oscilan perpendiculares uno del otro y ambos perpendiculares a la dirección
de propagación. |
 La
longitud de onda (l) es la medida de la distancia
de la mínima unidad repetitiva de una onda. La
longitud de onda (l) es la medida de la distancia
de la mínima unidad repetitiva de una onda. |
 El
espectro de radiaciones electromagnéticas (RE) se clasifica según
su longitud de onda y frecuencia. El espectro de la RE va desde los rayos
gamma, con baja longitud de onda y alta frecuencia, hasta las ondas de radio,
de alta longitud de onda y baja frecuencia. El
espectro de radiaciones electromagnéticas (RE) se clasifica según
su longitud de onda y frecuencia. El espectro de la RE va desde los rayos
gamma, con baja longitud de onda y alta frecuencia, hasta las ondas de radio,
de alta longitud de onda y baja frecuencia. |
 La
luz blanca está formada por toda la radiación del espectro
visible. Este hecho puede comprobarse haciendo pasar un rayo de luz blanca
a través de un prisma, el rayo de luz se descompone en todo el espectro
visible. Cuando un rayo de luz incide sobre un objeto, parte de la radiación
es absorbida por el objeto y el resto es dispersado. La
luz blanca está formada por toda la radiación del espectro
visible. Este hecho puede comprobarse haciendo pasar un rayo de luz blanca
a través de un prisma, el rayo de luz se descompone en todo el espectro
visible. Cuando un rayo de luz incide sobre un objeto, parte de la radiación
es absorbida por el objeto y el resto es dispersado. |
 El
color que percibimos es la suma de todos los colores dispersados. Para predecir,
de modo aproximado, el color de una solución o conocer que en que
color absorbe un objeto se utiliza la rueda de color. En la rueda de color,
los colores se distribuyen de forma que el color absorbido y el dispersado
son opuestos. El
color que percibimos es la suma de todos los colores dispersados. Para predecir,
de modo aproximado, el color de una solución o conocer que en que
color absorbe un objeto se utiliza la rueda de color. En la rueda de color,
los colores se distribuyen de forma que el color absorbido y el dispersado
son opuestos. |
 Por
estructura electrónica entendemos los diferentes niveles energéticos
que un electrón puede ocupar en un átomo o molécula.
Así, un electrón puede ocupar cualquiera de los diferentes
niveles energéticos propios, pero no puede situarse en un nivel intermedio
de energía. Los niveles energéticos reflejan la distancia
del electrón al nucleo atómico. Un electrón en un nivel
energético más alto está más alejado del nucleo
que otro situado en un nivel más bajo. Por
estructura electrónica entendemos los diferentes niveles energéticos
que un electrón puede ocupar en un átomo o molécula.
Así, un electrón puede ocupar cualquiera de los diferentes
niveles energéticos propios, pero no puede situarse en un nivel intermedio
de energía. Los niveles energéticos reflejan la distancia
del electrón al nucleo atómico. Un electrón en un nivel
energético más alto está más alejado del nucleo
que otro situado en un nivel más bajo. |
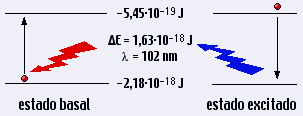 Los
electrones se pueden mover entre los distintos niveles de energía
mediante la absorción o la emisión de radiación electromagnética.
Cuando un electrón está en el nivel de energía más
bajo se dice que está en su estado basal. Este electrón puede
pasar a un nivel de energía superior mediante la absorción
de RE. Sin embargo, esta absorción sólo tendrá lugar
si la radiación tiene una energía exactamente igual a la diferencia
energética entre los distintos niveles. Se dice entences que el el
electrón se ha promovido a un estado excitado. La vuelta al estado
basal se produce con la emisión de una RE con la misma energía
que la diferencia de energía entre los dos niveles. Los
electrones se pueden mover entre los distintos niveles de energía
mediante la absorción o la emisión de radiación electromagnética.
Cuando un electrón está en el nivel de energía más
bajo se dice que está en su estado basal. Este electrón puede
pasar a un nivel de energía superior mediante la absorción
de RE. Sin embargo, esta absorción sólo tendrá lugar
si la radiación tiene una energía exactamente igual a la diferencia
energética entre los distintos niveles. Se dice entences que el el
electrón se ha promovido a un estado excitado. La vuelta al estado
basal se produce con la emisión de una RE con la misma energía
que la diferencia de energía entre los dos niveles. |
 Un
espectro es una representación gráfica de todas las longitudes
de onda de absorción o emisión de una determinada sustancia.
Para átomos los espectros de absorción y emisión presentan
bandas muy finas, mientras que las moléculas presentan unas bandas
más anchas debido a una mayor complejidad en su estructura electrónica. Un
espectro es una representación gráfica de todas las longitudes
de onda de absorción o emisión de una determinada sustancia.
Para átomos los espectros de absorción y emisión presentan
bandas muy finas, mientras que las moléculas presentan unas bandas
más anchas debido a una mayor complejidad en su estructura electrónica. |
 Como
tanto cada átomos como cada moléculas o compuesto tiene una
estructura atómica única, cada uno presenta un espectro de
absorción o emisión caracteristico. La espectroscopía
(de absorción y emisión) son las técnicas que nos permiten
identificar sustancias químicas mediante espectros. Como
tanto cada átomos como cada moléculas o compuesto tiene una
estructura atómica única, cada uno presenta un espectro de
absorción o emisión caracteristico. La espectroscopía
(de absorción y emisión) son las técnicas que nos permiten
identificar sustancias químicas mediante espectros. |