Tema 4. Relación entre la estructura y la función
|
Unión del oxígeno a la mioglobina |
|
| En un principio se pensaba que la función de la mioglobina era principalmente el almacen de oxígeno en los tejidos. Hoy parece claro que la función de la mioglobina es facilitar la difusión del oxígeno desde los capilares hasta el interior de las células (mitocondrias) que está limitada por la baja solubilidad del oxígeno en soluciones acuosas (~10-4 M). La función de almacen de oxígeno en los tejidos sólo parece ser relevante en los mamíferos acuaticos donde la concentración de mioglobina es aproximadamente 10 veces mayor que la que presentan los mamíferos terrestres. La unión del oxígeno al grupo hemo de la mioglobina provoca un cambio en las propiedades espectrofotométricas de las proteína, por tanto podemos determinar que fracción de la misma esta oxigenada mediante espectrofotometría. A un pH neutro la oxigenación de la mioglobina sigue una curva hiperbólica como la que aparece en la figura. Donde la fracción de saturación (θ) depende de la presión parcial de oxígeno.  La unión del oxígeno a la mioglobina se puede describir como un equilibrio simple donde: Mb + O2 ⇔ MbO2
|
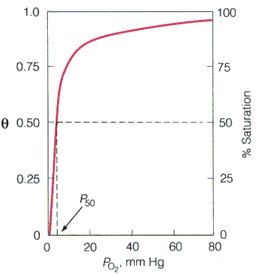 |
| donde Mb es la mioglobina desoxigenada y MbO2 es la mioglobina oxigenada. Como todo equilibrio químico podemos calcular una constante de equilibro (también llamada constante de asociación o afinidad), que vendrá dada por la expresión: donde [MbO2] representa la concentración de mioglobina oxigenada, [Mb] la concentración de desoximioglobina y [O2] la concentración de oxígen libre. Dado que la mioglobina posee un único sito de unión al oxígeno, el número de sitios totales es proporcional a la suma de [MbO2] + [Mb], y por tanto donde [O2]1/2 es la concentración de oxígeno a la cual la mitad de los sitios de unión de la mioglobina están ocupados. Como el oxígeno es un gas resulta más fácil medir la presión parcial del mismo que su concentración por lo que la expresión anterior se puede expresar como Esta ecuación se conoce como ecuación de Hill. Representando log(P50) frente a log(θ/1-θ) obtendremos una línea recta cuya pendiente es 1. |
|
Unión del oxígeno a la hemoglobina |
|
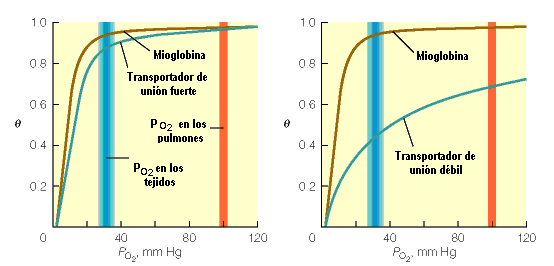
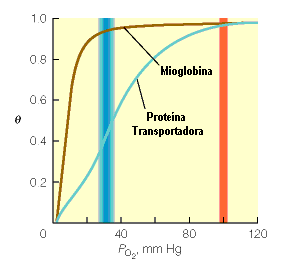
| La mioglobina es muy eficaz a la presión parcial de oxígeno existente en los tejidos se encuentra prácticamente saturada. Una proteína transportadora de oxígeno debe de cumplir una serie de requisitos para que resulte útil. Debe de presentar valores de saturación elevados a las presiones parciales de oxígeno presentes en los pulmones o branquias, y luego ceder una porción aceptable a las presiones parciales existentes en los tejidos. Es decir, una proteína transportadora ideal estaría saturada a la presión parcila de oxígeno de los pulmones o branquias e insaturada a la presión parcial de los tejidos. Si la unión del oxigeno a este transportador fuese conmo la que presenta la mioglobina pocría ser eficaz en la captura de oxígeno en los pulmones e ineficaz en la descarga del mismo en los tejidos o viceversa, eficaz en la descarga e ineficaz en la carga. | |
 |
|
| El problema se ha resuelto con una curva de saturación sigmoide. Este tipo de curva de saturación permite la saturación casí completa de la proteína transportadora a presiones parciales como las existentes en branquias y pulmones, y una liberación importante del oxígeno transportado cuando la presión parcial es equivalente a la de los tejidos. Este comportamiento se consigue con diferencias en la afinidad por el oxígeno de los distintos sitios de unión de la proteína en función de la unión anterior a otros lugares. La unión de una molécula de oxígeno a un primer sitio en la hemoglobina produce cambios conformaciones que faciitan la unón de las siguientes moléculas de oxígeno. Para estudiar la unión del oxígeno a la hemoglobina Hill consideró el siguiente equilibrio Hb + n O2 ⇔ Hb(O2)n Este equilibrio químico corresponde a una cooperativivadad máxima, es decir, se considera que la hemoglobina sólo está en dos estados, completamente desoxigenada o completamente oxigenada. Siguiendo el razonamiento de la representación de Hill tendremos:
y tomando logaritmos |
 |
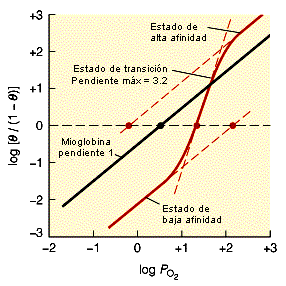 |
La representación de Hill para la hemoglobina resulta una curva como la que aparece en la figura de la izquierda. Cuando se unen las primeras moléculas de oxígeno, con la hemoglobina en estado de baja afinidad la curva muestra una pendiente aproximada de uno. Cuando se unen las últimas moléculas de oxígeno, con la hemoglobina en estado de alta afinidad, la pendiente vuelve a ser de uno. Entre ambos estados se encuentran los estados de transición. La pendiente máxima de esta parte de la curva nos da el valor del coeficiente de Hill (nH). La unión cooperativa del oxígeno a la hemoglobina es un ejemplo de lo que se denominan efectos alostéricos. En la unión alostérica, la unión de un ligando por una proteína influye en la afinidades de los restantes lugares de unión sin ocupar. Los ligandos pueden ser de la misma clase, como en el caso del oxígeno en la hemoglobina, o pueden ser diferentes. El alosterismo es un mecanismo importante de regulación de la actividad enzimática. |
Última actualización:
28-Jun-2005
Comentarios y sugerencias: José
Luis Urdiales