Tema 2
|
Propiedades ácido base de los aminoácidos |
|
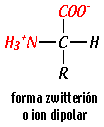
| En el interior celular los aminoácidos predominan en forma de ion
dipolar o zwitterion (del alemán ion híbrido). En la forma
dipolar el grupo carboxilo se encuentra disociado (-COO-) y el
grupo amino protonado (-N+H3), pero la carga de la
molécula es neutra. Un zwitterion puede actuar como un ácido
o como una base cediendo o aceptando protones. |
 |
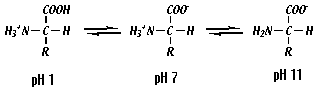 |
La protonación o desprotonación de los grupo amino y carboxilo depende del pH. Para la glicina el pKa para el grupo carboxilo y amino es respectivamente 2,3 y 9,6. esto significa que a pH inferiores a 2,3 los grupos carboxilo y amino estarán protonados, la carga neta de la molécula será positiva. A pH entre 2,3 y 9,6 el grupo carboxilo esta desprotonado y el grupo amino protonado, siendo la carga neta del aminoácido cero. A pH superiores a 9,6 ambos grupos estarán desprotonados, siendo la carga neta negativa. |
Valores de pKa para los grupos amino, carboxilo y la cadena lateral de los amino�cidos prote�nogen�ticos |
|||
|
Glicina
|
2,4 | 9,8 | -- |
|
Alanina
|
2,4 | 9,9 | -- |
|
Valina
|
2,3 | 9,7 | -- |
|
Leucina
|
2,3 | 9,7 | -- |
|
Isoleucina
|
2,3 | 9,8 | -- |
|
Metionina
|
2,1 | 9,3 | -- |
|
Prolina
|
2,0 | 10,6 | -- |
|
Fenilalanina
|
2,2 | 9,3 | -- |
|
Triptófano
|
2,5 | 9,4 | -- |
|
Serina
|
2,2 | 9,2 | -- |
|
Treonina
|
2,1 | 9,1 | -- |
|
Cisteína
|
1,9 | 10.7 | 8,4 |
|
Tirosina
|
2,2 | 9,2 | 10,5 |
|
Asparragina
|
2,1 | 8,7 | -- |
|
Glutamina
|
2,2 | 9,1 | -- |
|
Ácido aspártico
|
2,0 | 9,9 | 3,9 |
|
Ácido glutámico
|
2,1 | 9,5 | 4,1 |
|
Lisina
|
2,2 | 9,1 | 10,5 |
|
Arginina
|
1,8 | 9,0 | 12,5 |
|
Histidina
|
1,8 | 9,3 | 6,0 |
Dado que los grupos ionizables de los aminoácidos son ácidos relativamente débiles podemos aplicar la ecuación de Henderson-Hasselbalch para calcular la fracción de cada grupo que se encueltra ionizada a un determinado pH.
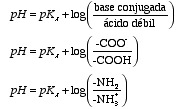 El
grupo a-carboxilo tiene un pKa entre 1,8 y 2.5, mucho
más bajo que el pKa del ácido acético (pKa = 4.8). Esto
se debe al efecto inductivo que ejerce el grupo amino que al estar protonado
atrae hacia si los electrones del grupo carboxilo favoreciendo la desprotonación
del mismo. Para un grupo carboxilo que tenga un pKa de 2.0 la proporción
de forma desprototonada a forma protonada a pH 7 será de 100.000 a 1,
es decir, a pH fisiológico la forma predominante es la de anión
carboxilato.
El
grupo a-carboxilo tiene un pKa entre 1,8 y 2.5, mucho
más bajo que el pKa del ácido acético (pKa = 4.8). Esto
se debe al efecto inductivo que ejerce el grupo amino que al estar protonado
atrae hacia si los electrones del grupo carboxilo favoreciendo la desprotonación
del mismo. Para un grupo carboxilo que tenga un pKa de 2.0 la proporción
de forma desprototonada a forma protonada a pH 7 será de 100.000 a 1,
es decir, a pH fisiológico la forma predominante es la de anión
carboxilato.
Para el grupo amino el valor de pKa varia entre 8,7 y 10,7. Así para un grupo amino cuyo pKa sea de 10,0 la razón base/ácido será de 1/1000 a pH 7. Esto datos confirman el hecho de que la forma predominante a pH neutro para los aminoácidos es la forma de zwitterion neutro.
| La siguiente imagen muestra como el aumento del pH influye en la cantidad relativa de de cada una de las posibles formas iónicas del aminoácido aspartato (pulsar en la tecla verde para comenzar la animación). |
Última actualización:
16-May-2005
Comentarios y sugerencias: José
Luis Urdiales