Tema 3
Estructura Tridimensional de las Proteínas
|
|
|
|
Proteínas fibrosas y globulares
Las proteínas pueden clasificarse en dos grandes grupos, el de las proteínas
fibrosas y las proteínas globulares. Las proteínas
fibrosas son generalmente proteínas estáticas, cuya función
principal es la de proporcinar soporte mecánico a las células
y los organismos, suelen ser insolubles y están formadas por una unidad
repetitiva simple que se ensambla para formar fibras. Entre las proteínas
fibrosas podemos encontrar la alfa-queratina, componente principal del
pelo y las uñas; el colágeno, presente en la piel, los
tendones, huesos y dientes.
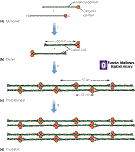
Las alfa-queratinas
| Las queratinas son las proteínas más abundantes del del
pelo y las uñas y forman parte de la piel de los animales. Las alfa-queratinas
son miembros de las proteínas filalentosas intermedias, que realizan
un función estructural muy importante en el el nucleo, citoplasma
y superficie de muchos tipos celulares. La estructura típica de las
queratinas es la siguiente: las moléculas individuales poseen largos
fragmentos (aprox. 300 residuos) estructurados en forma de alfa-hélice.
Un par de hélices se enrollan entre si para formar la estructura
de ovillo enrollado a izquierdas; dos ovillos enrollados vuelven
a unirse para formar una protofibrilla de cuatro moléculas;
finalmente, ocho protofibrillas se unen para formar una microfibrilla,
que es la base de la estructura del pelo. Las microfibrillas son elásticas
y flexibles. |
 |
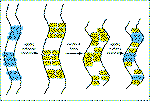 |
Las alfa-queratinas presentan un mayor porcentaje de cisteínas
que otras proteínas, con lo que se pueden establecer puentes disulfuros
entre las distintas estructuras helicoidales, lo que da mayor rigidez a
las microfibrillas.
Mediante la aplicación de agentes reductores y de calor húmedo
se puede cambiar el patrón de enlaces disulfuro entre las distitas
cadenas polipeptídicas. Aplicando agentes oxidantes, una vez que
el cabello se ha moldeado según la forma deseada, se consigue que
se estableza un patrón de puentes disulfuro diferente y el cabello
queda ondulado de modo "permanente". |
|
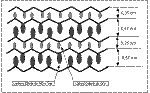
La fibroína de la seda
Pauling y Corey postularon su modelo de hoja beta tras analizar
los datos de difracción de rayos X de la fibroína de la seda,
proteína formada por hojas beta antiparalelas ordenadas. La mayoría
de estas proteínas están formadas por repeticiones de la secuencia:
-[Gly-Ala-Gly-Ala-Gly-Ser-Gly-Ala-Ala-(Ser-Gly-Ala-Gly-Ala-Gly)8]n-
| Dado que los residuos de las cadena laterales se disponen alternativamente
a uno y otro lado de la cadena polipeptídica, los hidrógenos
de la glicina se situarían a un lado de la cadena y los grupos metilo
e hidroximetilo, de la alanina y serina, se situarían al otro lado
de la cadena permitiendo un estrecho empaquetamiento de las cadenas. La
flexibilidad de la fibroína de la seda se debe a que las cadenas
se mantienen unidad solo por fuerzas de van der Waals entre las cadenas
laterales. |
 |
El colágeno
 |
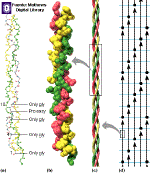
El colágeno es una proteína fibrosa
componente de la piel, los huesos, los tendones y los dientes. La unidad
básica de la fibra de colágeno es una triple hélice
denominada tropocolágeno Cada cadena del tropocolágeno,
de unos 1000 residuos de longitud, está formado por una hélice
a izquierda con 3,3 residuos por vuelta y 0,29 nm de elevación. Las
tres cadenas que forman el tropocolágeno se enrollan entre sí
a derechas. La secuencia de aminoácidos del colágeno es extraordinariamente
regular. Prácticamente cada tres residuos contiene una glicina, también
presenta una mayor proporcion de prolina que el resto de las proteínas.
Otra caracteristica es la presencia de residuos de 4-hidroxiprolina, aminoácidos
que raramente se encuentra en otras proteínas. Los residuos de glicina
se situan en la zona del tropocolágeno donde las tres hélices
se encuentran más cerca, lo que hace que sea este aminoácido
el único que no presente impedimentos estéricos en dicha posición. |
| Las moléculas de tropocolágeno se empaquetan
juntas según se muestra en la figura. Esta disposición proporciana
una notable resistencia que se ve favorecida por la aparición de
enlaces cruzados entre residuos de lisína de moléculas de
tropocolágeno adyacentes. La formación de estos enlaces cruzados
es un proceso que dura durante toda la vida lo cual favorece la perdida
de elasticidad del colágeno en las personas mayores. |
 |
Última actualización:
16-May-2005
Comentarios y sugerencias: José
Luis Urdiales