Tema 3
|
Los enlaces covalentes son el principal factor de
estabilización de los compuestos orgánicos y también
mantienen a los átomos unidos en conformaciones geométricas
específicas. No obstante, a pesar de que las energías de
los enlaces no covalentes son inferiores a las de los enlaces covalentes,
las diversas fuerzas atractivas no covalentes tienen una gran importancia.
Este tipo de inetracciones son las responsables de mantener la estructura
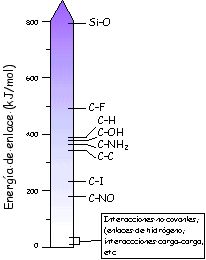
de las biomoléculas. ¿Qué es lo que que hace que las interacciones no covalentes sean tan importantes en Biología y Bioquímica? Los enlaces covalentes más importante en Bioquímica son los enlaces C–C, C–H, C–OH y C–NH2, cuya energía de enlace oscila entre 300 y 400 kJ/mol. Las interacciones no covalentes son de 10 a 100 veces más débiles. |
 |
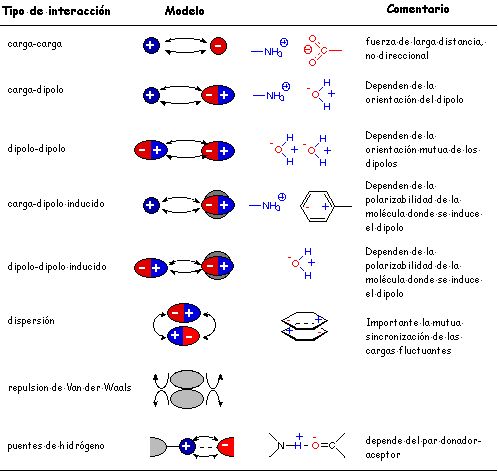 |
En la tabla aparecen las principales interacciones
no covalentes que son importantes en el el mantenimiento de la estructura
de las proteínas. La menor energía de estas interacciones las hacen importantes dado que pueden romperse y volverse a formar durante las interacciónes moleculares. Las interacciones moleculares dependen de un rápido recambio de parejas moleculares que podría no producirse si las interacciones fuesen más fuertes. Además estas interacciones también estabilizan la estructura cuaternaria de las proteínas, nivel de organización que aparece en las proteínas compuestas por más de una cadena polipeptídica. La estructura cuaternaria se refiere a como las distintas cadenas polipeptídicas se asocian entre sí y se disponen espacialmente. |
Última actualización:
16-May-2005
Comentarios y sugerencias: José
Luis Urdiales